【目次】
1. 胆道内標的細胞運搬用セルフロック・着脱式モジュール型ロボット
2. 大腸内薬物運搬の高速自己定位・耐蠕動接着可能の着脱式マイクロニードルロボット
3. 血栓位置診断と血栓溶解促進向けのスパイラルロボット
4. 手術治療向けの小型ソフトロボット
マイクロロボット(microrobot)は、外部からのエネルギーを自律的な運動に変換できるミリメートル以下の微細装置です。小型で自主的に動き、柔軟性が高いため、従来の医療手段ではアクセス困難な狭い領域にも到達することができ、新しい医療ツールとしての応用が期待されています。薬物/細胞運搬、医療用イメージング、低侵襲診断・治療、バイオセンシングと検出、組織工学などのバイオメディカル分野での応用が期待されています。
従来のマイクロロボットの製造方法と比較して、精密3Dプリンティング技術は、超高精度の微細構造を製作することができます。簡単なプロセス、低生産コスト、高い処理効率を特徴とし、製造の難易度とコストを大幅に削減出来ます。BMFのマイクロ3次元リソグラフィ(PμSL)技術のマイクロロボットの関連部品は、細胞/薬剤標的運搬、イメージングとモニタリング、手術ロボット、スマートセンサーなど、多くの研究分野に応用されています。
以下、医療関連分野でPμSL技術による3Dプリント・マイクロロボットの応用事例を紹介します。
1. 胆道内標的細胞運搬用セルフロック・着脱式モジュール型ロボット
2. 着脱式マイクロニードルロボット:腸内薬物送達のための迅速な自己定位と蠕動運動防止接着が可能
3. 血栓位置特定と血栓溶解促進向けスパイラルロボット
4. 外科治療向け小型ソフトロボット
1. 胆道内標的細胞運搬用セルフロック・着脱式モジュール型ロボット
細胞のキャリアとして、マイクロロボットは自主的に標的部位に正確に細胞を運搬する事ができるため、従来の細胞運搬戦略におけるターゲティングの不足や効率の低さという難点を解決することができます。
しかし、これらのマイクロボットの細胞機能とマグネトロンの機能には無視できない矛盾があります。すなわち、強力なマグネトロン能力を追求する為磁性体を大量に添加すると、マイクロボットの細胞活性が低下し、細胞の接着、放出、分化行動に深刻な影響を及ぼし、生体内での停滞や分解による生体毒性を引き起こす可能性さえあります。
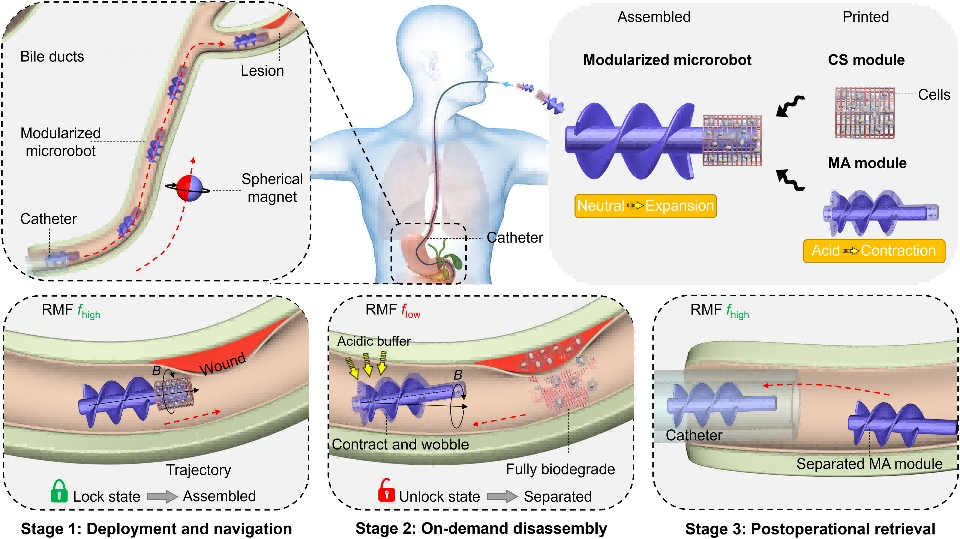
図1 胆道内標的細胞運搬システム用モジュール式マイクロロボットの模式図
細胞機能とマグネトロン機能の両立という課題を解決するために、Kai Fung Chanらは、マイクロロボットの多機能モジュール設計戦略を提案しました(図1)。駆動性能と細胞活性の非互換性という課題を解決し、胆管における幹細胞の標的運搬に使用することに成功しました。
関連研究成果は“Modularized microrobot with lock-and-detachable modules for targeted cell delivery in bile duct”と題され、『Science Advances』誌に掲載されました。
マイクロロボットは主に磁場駆動(Magnetic actuation, MA)モジュールと細胞ステント(cell scaffold, CS)モジュールで構成されています。MAモジュールは強力な磁気とpH応答性の変形機能を持ち、CSモジュールは細胞の充填と放出機能を持っています。この二つのモジュールには、それぞれ特定のpH応答性磁性ハイドロゲルと生分解性ハイドロゲルが設計されています。MAモジュール中のNdFeB磁性粉末の含有率は約33wt%と高く、CSモジュールの細胞搭載能力や生分解性に影響を与えないだけでなく、強力な磁気特性を持っています。上記のモジュールサンプルは、BMF 3Dプリンター(microArch®S130, BMF)を用いて作製され、CSモジュールの細胞ステントは、孔内径850μm、最小ロッド径20μmになります。MAモジュールの磁気駆動ローターの肉厚は約100μm、ロッド径は650~1150μmです。
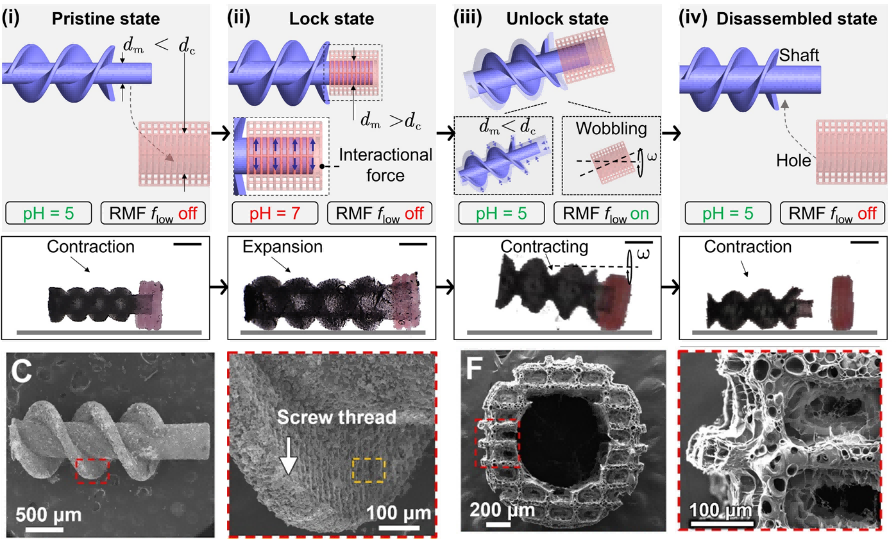
図2 MAモジュールとCSモジュールの組立・分解工程の模式図とSEM図
フロントエンドの介入運搬-バックエンドの磁気制御ナビゲーション(front end interventional delivery - back end magnetron navigation)というマルチレベルの運搬戦略を採用し、MAモジュールが磁気駆動を持ち、酸性環境で収縮し、アルカリ性環境で膨張する特性を利用して、マイクロロボットを標的病巣に迅速に送達した後、急性・慢性胆嚢炎、胆管炎、胆管閉塞などの疾患による局所pHが低下した領域でMAモジュールを収縮させ、CSモジュールから分離させます。
最後に、CSモジュールは胆汁中の消化酵素によって徐々に分解され、病変を治療するための細胞を放出し、MAモジュールは磁気にカテーテルに駆動されて回収されます。
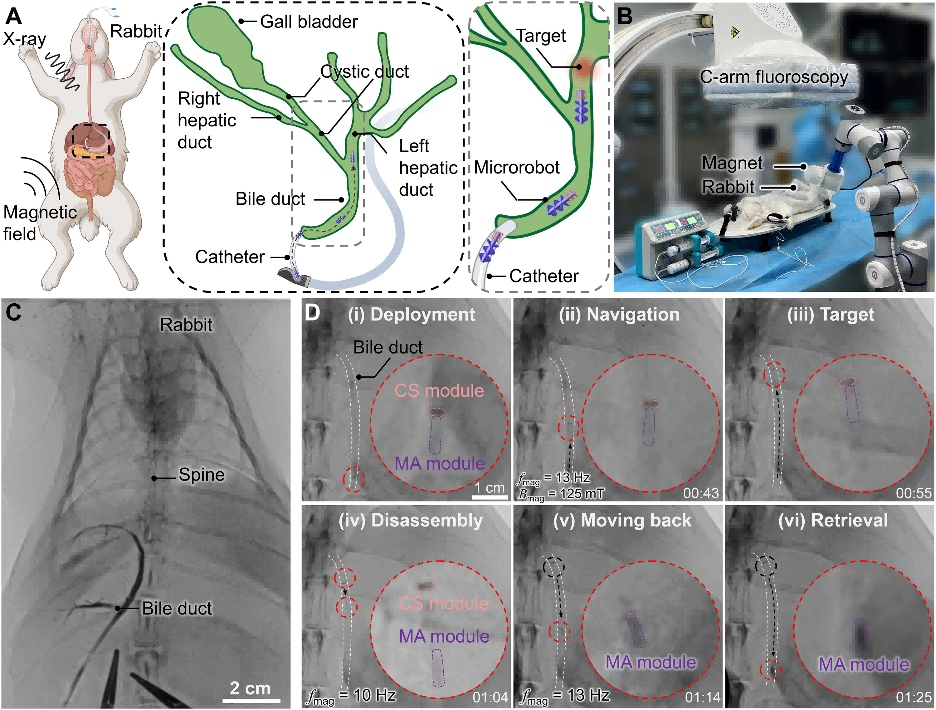
図3 ウサギ肝臓内におけるモジュール型マイクロロボットの標的運搬
胆管モデルで、モジュール型マイクロロボットによる介入運搬-磁気制御ナビゲーション-必要に応じた分離-CSモジュールの放出-MAモジュールの回収の全プロセスが実証され、モジュール型マイクロロボットが効率的で安全な標的細胞運搬を実現できることが示されています。標的運搬の実現可能性は、ニュージーランド白ウサギを用いた実験で更に検証され、その全過程をX線および超音波イメージングによってリアルタイムで観察することができます(図3)。
この論文で、モジュール設計に基づく戦略を提案し、マイクロボットに優れた磁気駆動能力と細胞機能性を同時に付与することで、従来の細胞運搬のマイクロボットが直面していた問題を効果的に解決し、将来の胆管疾患に対する非侵襲的細胞標的治療の新たな可能性を提供しました。
原文リンク:https://doi.org/10.1126/sciadv.adj0883
2. 大腸内薬物運搬の高速自己定位・耐蠕動接着可能の着脱式マイクロニードルロボット
マイクロニードルを搭載したマイクロロボットは、経粘膜薬物送達(transmucosal delivery)と薬物放出制御の能力を持っています。外界(external fields)の制御下で薬剤を正確に送達することができ、胃酸やpH変化の影響から薬剤を保護し、特に生体分子薬剤の送達に適しており、消化管における薬剤運搬の新しい効果的な方法を提供します。しかし、複雑な制御モジュール、運動性や癒着挙動に関する理論の欠如、蠕動や体液の流れによる失敗、腸閉塞の危険性など、多くの課題が残っています。
この為に、Lei Renらは、大腸粘膜を介した薬物運搬向けの、流線型で低重心構造のボーラス不要のマイクロニードルロボットを設計しました(図4)。このロボットは、制御システムの必要性を排除し、迅速な自己標的化と粘膜への接着を可能にし、生理的蠕動に対抗し、閉塞のリスクを低減する事ができます。
関連研究内容は、“Tumbler-Inspired Microneedle Containing Robots: Achieving Rapid Self-Orientation and Peristalsis-Resistant Adhesion for Colonic Administration”と題され、『Advanced Functional Materials』誌に掲載されています。
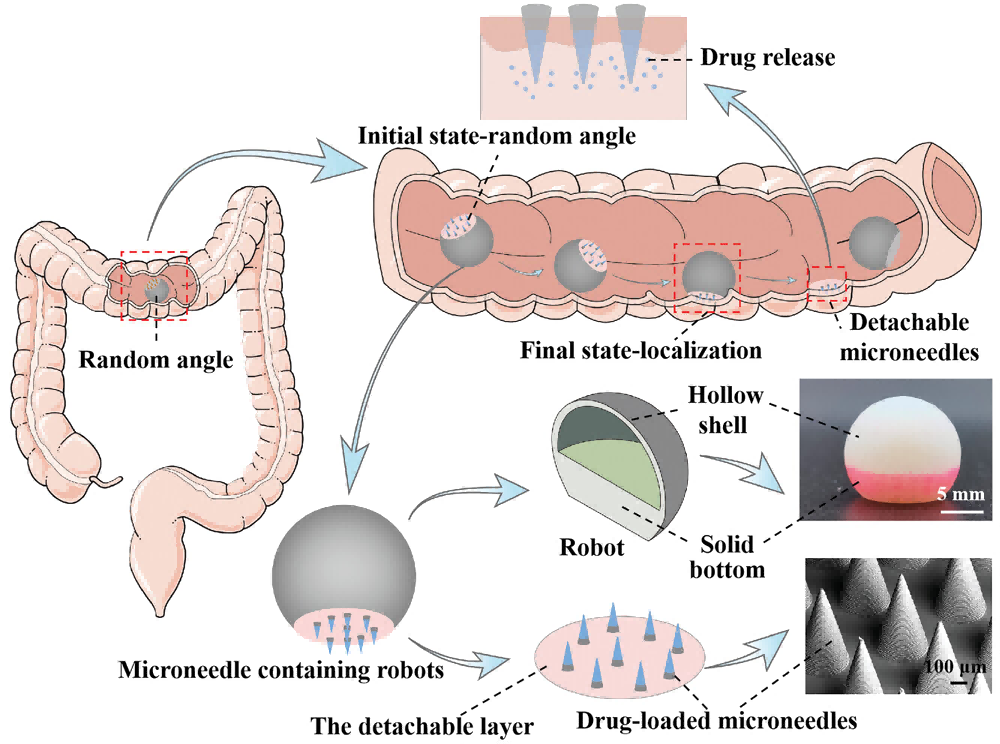
図4 大腸薬物運搬向けの高速自己配向型マイクロニードルロボットの設計とメカニズム
まずBMF 3Dプリンター(microArch®S140, BMF)を用いて、マイクロニードル基部直径300μm、高さ600μm、マイクロニードル間隔450μmのミクロンサイズのマイクロニードルアレイを製作し、次にPDMS転写技術と組み合わせてキトサン(chitosan, CS)ゲルマイクロニードルを製作し、除去可能な層を、大腸液(colonic juice)中の酵素によって速やかに分解されるポリビニルアルコール(PVA)/ポリビニルピロリドン(PVP)で製作しました。
本マイクロロボットは、マイクロニードルをゼブラブタの大腸に運び、重力と大腸蠕動運動の複合的な力の下で、外部制御システムなしで、5秒以内に自己定位を達成して、マイクロニードルの粘膜への挿入され、その後、大腸液中で分離可能な層が徐々に分解され、80秒以内にマイクロニードル・アレイからマイクロロボットの分離が観察されます。最終的に挿入されたマイクロニードルアレイは粘膜に保持され、ゆっくりと溶解して薬剤を放出するが、マイクロニードルアレイから分離されたマイクロロボットは1時間以内に体外に排出され、大腸閉塞を回避することができます。さらに、薬物を運ぶマイクロニードルを設計することにより、それぞれ14分、2日、4日、30日と異なる薬物放出時間を達成することができます。
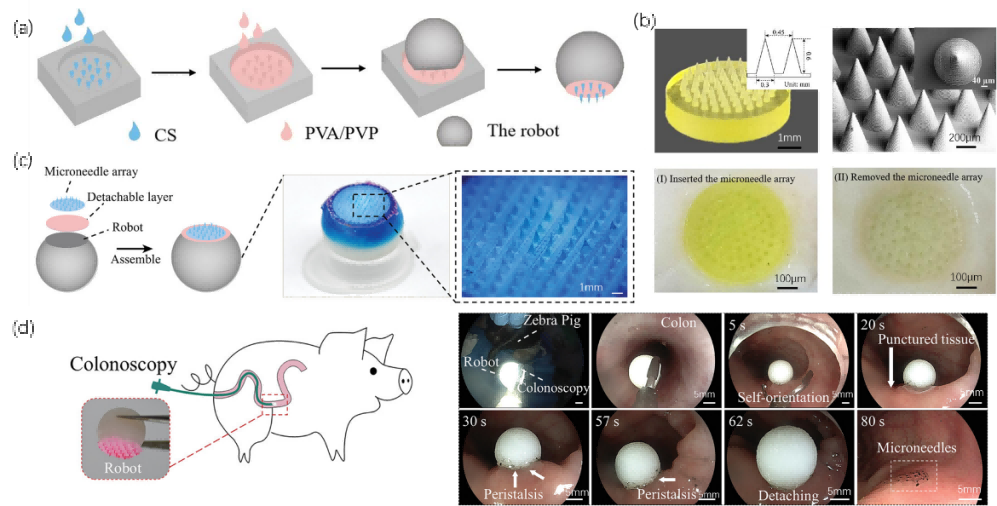
図5 着脱式マイクロニードルロボットの主な構成要素、及びゼブラブタの大腸での実験写真
実験の結果、着脱式マイクロニードルロボットは、自己ターゲティング及び抗組織接着大腸薬物送達を達成する上で優れた実現可能性を有し、侵襲的な外科的介入や患者の苦痛を軽減するために、慢性炎症や大腸癌などの疾患を治療するための多目的なプラットフォームとして使用できることが示されました。
原文リンク:https://doi.org/10.1002/adfm.202304276
3. 血栓位置診断と血栓溶解促進向けのスパイラルロボット
血栓症は、心筋梗塞、脳卒中、肺塞栓症など、様々な臨床症状や合併症を伴う一般的な血管内疾患で、患者の生命、健康、生活の質を著しく危険にさらします。従来の治療法では、血栓溶解剤の注射やカテーテルによる血栓除去から始まり、二次的な閉塞を防ぐために抗凝固剤を使用することが多かったです。しかし、血栓溶解薬はターゲティングに欠け、血栓部位に積極的に濃縮することができず、高濃度の薬剤は内出血や血圧変動を起こしやすいため、効率的かつ安全に血栓を除去することが困難です。一方、カテーテルインターベンション技術は、術者側に高度な経験と判断力が要求され、不適切な操作では容易に血管を損傷したり、二次的な閉塞を引き起こしたりする可能性があります。
近年、小型のロボットシステムは、狭くて閉塞した生物学的環境での応用に大きな可能性を示しており、研究者は血栓の構造を破壊できるマイクロロボットを開発しました。しかし、複雑な血流環境において、小型ロボットの制御された標的運搬とリアルタイムの状態監視を実現することは、依然として大きな課題になります。Li Zhangらは、ドップラー超音波ガイダンスの下で(ultrasound Doppler imaging guidance)、複雑な血流環境におけるヘリカルロボットのナビゲーションを自動化するスキームを提案し(図6)、血栓の位置特定と血栓溶解効率の促進という生物医学的応用の探求を達成しました。
関連研究結果は、“Real-Time Ultrasound Doppler Tracking and Autonomous Navigation of a Miniature Helical Robot for Accelerating Thrombolysis in Dynamic Blood Flow”と題され、『ACS Nano』誌に掲載されています。
本研究では、ポリエチレングリコールジアクリレート(PEGDA)を印刷材料とし、BMF技術(microArch®S130, BMF)を用いて直径2.15mm、長さ7.30mmのスパイラル型マイクロロボットを一体造形し、ネオジム-鉄-ボロン(NdFeB)磁石を埋め込むスペースを確保しました。
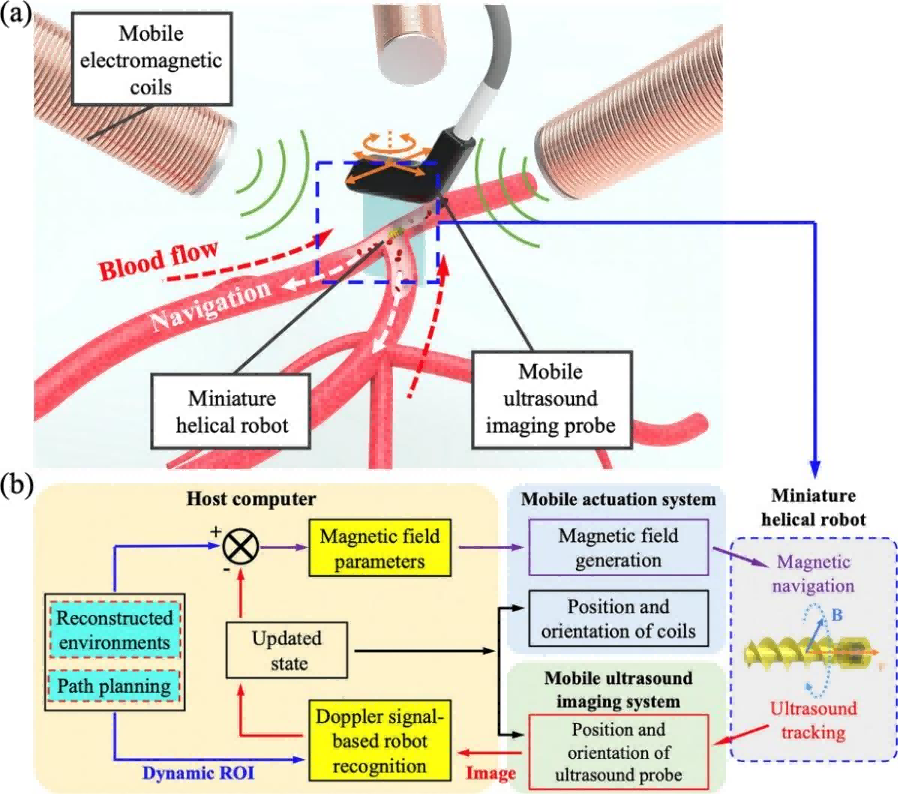
図6 動的な血管のような環境におけるスパイラルロボットの自動誘導のソリューション
磁場によって駆動されるヘリカルロボットは、血栓溶解因子の物質交換を促進する強力な対流を発生させることができ、同時に血液-血栓界面に剪断力を作用させて血栓溶解産物の除去を促進します。従来の組織プラスミノーゲンアクチベーター(tPA)血栓溶解療法と比較して、ヘリカルロボットによる剪断応力の増強と、tPAが血栓と血液の界面付近で発生させる対流により、目に見える血栓断片を発生させることなく、血栓除去率が4.8倍、血栓溶解効率が3.5倍に増加し、二次閉塞のリスクが減少しました(図7)。
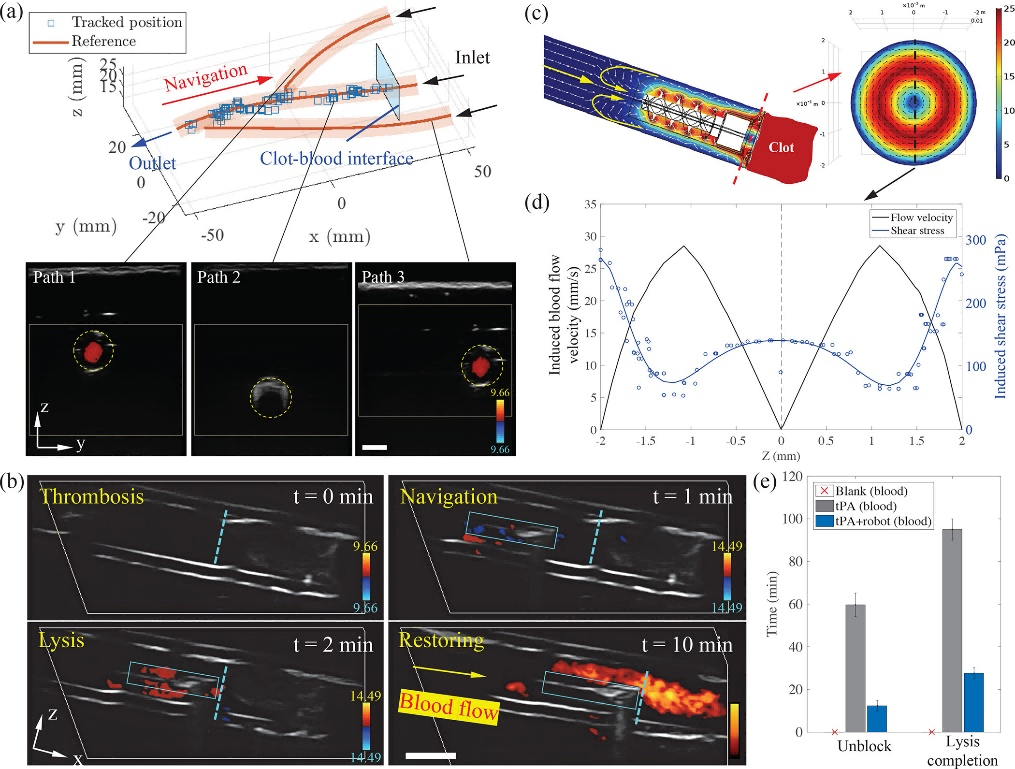
図7 ドップラー信号誘導による血栓位置特定と血栓溶解の促進
精密3Dプリントされたヘリカルロボットは、血液環境や血流環境において優れた構造安定性を示し、環境モニタリングによりリアルタイムで位置決めでき、完成した全体構造を維持し、血栓除去ミッション後に回収されます。さらに、このヘリカルロボットは、様々な狭い生物学的環境での応用のために、必要に応じてサイズを拡大することができます。 本研究は、血栓症のモニタリングや治療に新たなアイデアを提供するとともに、生物医学的応用における小型ロボットの道を開くものと期待されています。
原文リンク:https://doi.org/10.1021/acsnano.1c07830
4. 手術治療向けの小型ソフトロボット
ソフトロボットとは、自然界に生息する軟体動物の柔らかい構造や動きを模倣し、柔軟な素材に基づいて製造される新しいタイプのロボットになります。このロボットは無制限の自由度と連続的な変形能力を持ち、従来のロボットで到達できなかった特殊な環境での作業や通常の作業にも強い適応性を持ちます。また、柔らかい構成材料により、人間とロボットの相互作用がより可能になり、幅広い応用が期待できます。
香港城市大学のYajing Shen教授が率いるチームは、磁力と腱によって駆動される優れたステアリングとナビゲーション能力を持ち、複雑な制限環境に適応しながら高精度の操縦が可能なミリメートルスケールのソフト連続体ロボットを開発しました(図8)。
関連研究結果は、“Millimeter-Scale Soft Continuum Robots for Large-Angle and High-Precision Manipulation by Hybrid Actuation”と題され、『Advanced Intelligent Systems』誌に掲載されています。
ミリメートルスケールの混合駆動を実現するため、研究チームは、BMFの10μm高精度3Dプリンター(microArch®S240)を使用して、薄壁に150μmの貫通孔を設けた極薄スケルトンロボット(長さ30mm、外径3.0mm、肉厚300μm)をプリントしました。 ロボット表面には、磁気作動用に100~150μmの強磁性複合エラストマーコーティングも施しました。
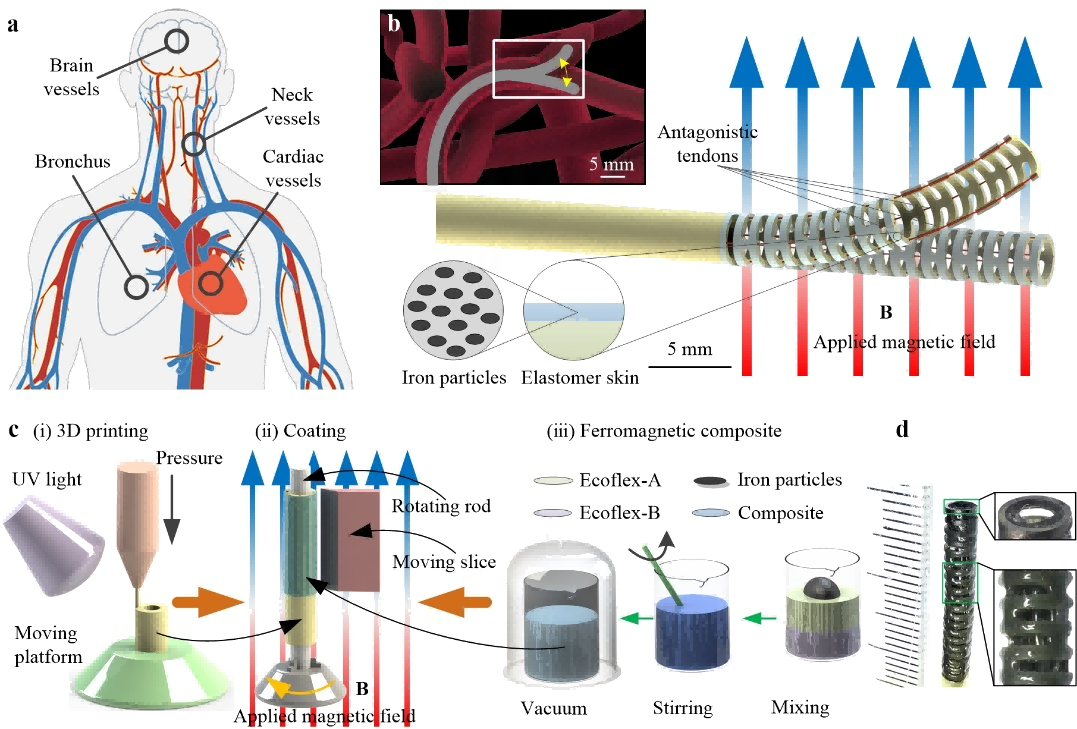
図8 磁気・腱ハイブリッド駆動方式(hybrid magnetic- and tendon-driven mode)の小型軟体連続ロボット(small-scale soft continuum robot)設計図
このソフトロボットは、腱の作動で100°まで曲げられ、作業スペースが広いため、複雑な枝分かれした血管の中を進むことができます。 印加磁場の存在下でより優れた作動性能を発揮するこのロボットは、静的位置決め精度が2μm、動的追跡誤差が10μmと、既存の技術に比べて約30倍向上しています。狭窄血管モデルにおいて、このソフト連続体ロボットは、病理学的部位の探索(図9a)、搬送された低侵襲手術ツールのフロントエンドへの搬送(図9b)、外部磁場によって駆動可能なマイクロ注射やマイクロ切除などの高精度マイクロマニピュレーション(図9c、d)を可能にします。さらに、磁場駆動モードで開発されたミリメートル・スケールのソフトロボットは、上咽頭スワブを持ち運ぶことで、上咽頭サンプリングの機能も果たすことがでます(例図9e,f)。
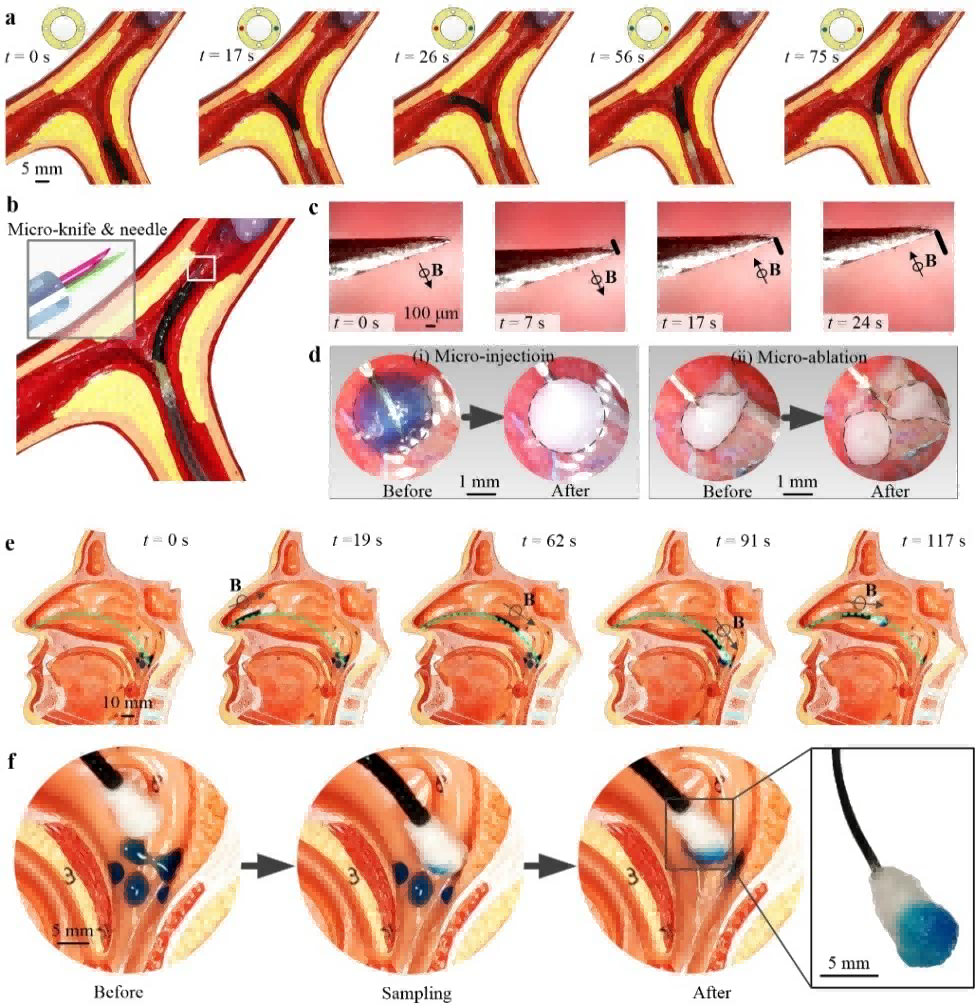
図9 血管モデル内操作と鼻咽頭サンプリングのデモンストレーション
小型、しなやかな駆動、大きな旋回角、高精度を備えた3Dプリントソフトロボットは、腱駆動と磁場駆動を組み合わせることで、血管シミュレーションの分岐トンネル内で優れた操舵能力と正確な追跡能力を発揮し、生体医工学への応用に大きな可能性を示すと期待されています。
原文リンク:https://doi.org/10.1002/aisy.202000189
現在、マイクロロボットの臨床応用にはまだまだ長い道のりがありますが、将来的には、3Dプリンティング技術の進歩、新素材の開発、他の技術との組み合わせにより、医療分野におけるマイクロロボットの応用はますます多様化、個別化し、より正確で、より効果的で、より快適な治療法を患者に提供できるようになるでしょう。







